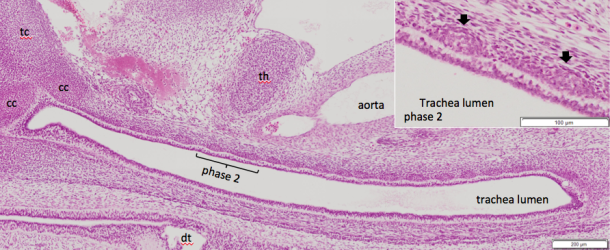
Return of the intestinal loop and superior mesenteric artery to the abdominal coelom after physiological umbilical herniation
生理的臍帯ヘルニアの還納過程における3次元的解析 掛谷真樹
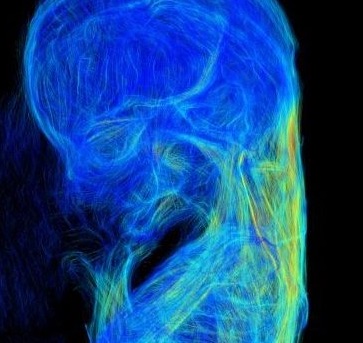
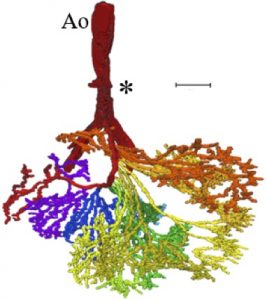
【背景】ヒトの胎児では、発生過程で一時中腸が腹腔から臍帯内へと脱出する(生理的臍帯ヘルニア)。頭殿長(Crown Rump Length: CRL)40mm 前後に中腸は腹腔に還納するが、還納過程の中腸、特に小腸の位置、形態や還納後の位置については不明な点が多い。本研究では、腸管の詳細な還納方法を明らかにするため、小腸の還納の順序・還納方法、還納後の腸管の位置関係の変化の検討を行った。また、小腸・結腸を栄養し、その成長に大きく関係すると考えられる上腸間膜動脈(Superior mesenteric artery: SMA)の検討も行った。
【方法】ドイツゲッティンゲン大学が保管するヒト胎児標本群 Blechschmidt CollectionのうちCRL30.0-50.0mm の標本計10個体の連続組織切片をデジタル化したものから、十二指腸起始部から肛門までの腸管とSMAの立体再構成像とその中心線を作成した。この中心線をもとに腸管について1)ヘルニア還納に伴う位置変化の観察、2)臍帯輪通過時の腸管の観察と屈曲度の解析を行った。SMAの小腸枝の分岐を指標に小腸を十二指腸側から4つの領域A-Dに区分してその位置、形態変化を検討した。また、SMAについて1)ヘルニア還納に伴う形態変化の観察、2)小腸枝の長さを用いた定量的解析を行った。
【結果】腸管について:1)位置変化の観察;生理的臍帯ヘルニア期に、十二指腸側の領域Aは一部のみ脱出し、その他の3領域は全体が脱出した。還納時、回腸末端部が最後に還納し、還納後には十二指腸から順に腹腔右側から左側へと占領区域を変えて位置した。2)臍帯輪を通る腸管は全例上行脚と下行脚2本であった。また、腸管は臍帯内・腹腔内ではループ状に曲線を描いて存在するのに対し、臍帯輪を通過する時は屈曲が小さく直線的であった。SMAについて:1)ヘルニア期に広がりを見せなかった小腸枝は、還納期になると腹腔左上から右下にかけて扇状に広がった。2)第4小腸枝が最長であること、第8小腸枝までとそれ以降の小腸枝とで長さや分岐の傾向が異なった。
【結論】生理的臍帯ヘルニアの還納方法は、臍帯腔に脱出して二次腸ループを形成していた腸管が一度直線状になって臍帯輪を通過して腹腔に戻り、腹腔内で再び二次腸ループを形成するという可能性が示された。また、ヘルニア還納に伴うSMAの形態変化や、個体間で共通するSMAの小腸枝の特徴を明らかにした。
56.Kakeya M, Matsubayashi J, Kanahashi T, Männer J, Yamada S, Takakuwa T. The return process of physiological umbilical herniation in human fetuses: the possible role of the vascular tree and umbilical ring. J Anatomy 2022, 241(3), 846-859. https://doi.org/10.1111/joa.13720
Fixation of the colorectum in the abdominal coelom during normal human development
ヒト胎児期における大腸の還納、固定時期の解析 黄 柔婷
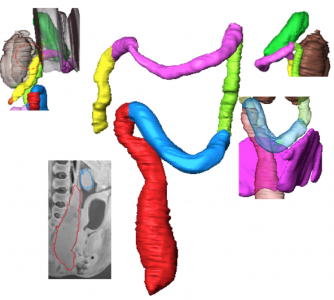
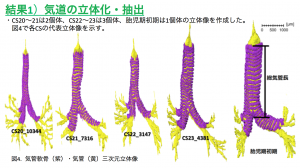
【背景】ヒトの中腸は、胚子期に一時的に臍帯腔に脱出し、頭臀長(CRL) 40 mm前後に、速やかに腹腔に還納する。その後、各部位の結腸は、所定の位置に固定する。しかしながら、各部位の結腸の還納や固定過程についての記載は、まだ十分とはいえない。
【対象と方法】京都大学大学院医学研究科附属先天異常標本解析センターに保管されているヒト胚子、胎児期初期標本のMRI画像データ40例 (ヘルニア期3例;移行期12例;還納期25例, 頭殿長(CRL)=22〜225mm)を対象とした。三次元画像解析ソフトAmiraを用いて腹膜腔と後腹膜腔に位置する諸器官の立体再構成像を作成し、1)結腸の走行の変化と周辺器官の関係を観察、2)結腸直腸各領域の長さの計測3)上行結腸(AC)と下行結腸(DC)の後腹膜への固定時期とその割合、を検討した。
【結果】ヘルニア期・移行期;CRL22mmでは、中腸ループの遠位肢の形状は、尿膜管と臍帯動脈に沿って走る正中矢状面上でほぼ直線状で、横行結腸(TC)とDCとの境界となる中腸と後腸の境界が、屈曲点として検出された。CRL26.8 mmでは、中腸の遠位端が胃と十二指腸・空腸移行部と近接し、湾曲を形成した。CRL32mmでは、矢状面から左に偏位した湾曲ループがみられた。直腸(Rt)は仙骨に沿った湾曲を示した。環納期; DCとS状結腸(SC)との境界はCRL50mmからみられ、AC,TC間の境界以外は識別可能であった。AC およびTCの走行は、右腎、肝、胃、十二指腸の位置に影響された。 つまりACは回盲部から右腎に沿って腹側、頭側へ、次に肝臓下面に沿って内側に、そして膵臓、十二指腸、そして胃の大きな湾曲に沿って走行した。固定開始前のDCの長さ(CRL 62 mm未満)は約3〜5 mmで伸長はみられなかった。 CRL62 mmでDCが後腹膜に融合し始めると、DCは、固定の進行と並行して伸長した。膵結腸靭帯は、CRL62mmのサンプルで検出された。CRL75mmで横隔膜結腸靭帯、CRL97mmで脾臓結腸靭帯が確認された。CRL105mm以上の標本でTCとACの境界は十二指腸と右腎臓に近い領域で顕著になった。同時期にAC後腹膜への融合は口腔側から肛門側に進行し、ACの長さも増加した。CRL 131mmの個体では、ACと肝臓の間の靭帯(肝結腸靭帯)が観察された。CRL 131mmでは、すべてのDCが後腹膜に融合したRtはCRLが増加すると、曲率の程度は徐々に減少し、 CRL131 mmのサンプルでは、Rtの形状はほぼ直線状になった。SCの長さは成長に応じて直線的に増加した。 CRLが180mm未満の標本では、SCの走行は不規則であったが、180mmを超えると、走行はU字型になった。
結直腸の全長は、CRLの増加と強い相関がみられた。中腸(AC + TC)および後腸(DC + SC + Rt)の比率は、ほぼ一定で平均44.0±3.5%および56.0±3.5%(CRL38.5 mm以上 n=32)であった。全領域が判別可能な個体(CRL105mm<, n=11)においてAC, TC, DC, SC, Rtの比率は、15.3±6.4%、42.1±7.9%、18.6±4.0%、24.0±4.5%, 23.3±3.7%であった。TCの比率が最も大きく、次いでSCであった。 ACとDCは同様の比率を示した。
【結論】胎児期初期から中期の結腸、直腸の走行、伸長について詳細なタイムラインを作成した。結腸直腸の走行は、腎臓、肝臓、膵臓、胃・十二指腸の影響を受けた。DC, ACの後腹膜固定は領域ごとの伸長に影響を与えた。胎児期中期の各領域の割合は、報告されている成人結腸直腸における各領域の割合とほぼ同様であった。周辺器官間の靭帯をいくつか特定できたが、結腸間膜等の間膜を正確に捉えることは難しく、周辺諸器官と影響する機序は、今後の課題と考える。得られたタイムラインは、今後、胎児検診や出生前診断における画像診断の際の標準値として臨床応用が期待される。
 4回生の卒業研究発表会が、基礎系、理工系、臨床系にわかれて行われました(2022.1.26-28,杉浦ホール)。
4回生の卒業研究発表会が、基礎系、理工系、臨床系にわかれて行われました(2022.1.26-28,杉浦ホール)。