概要
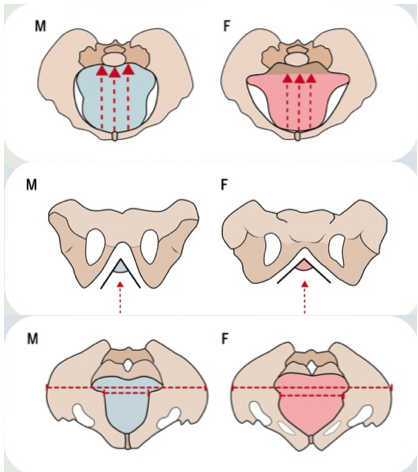
骨盤入口部、恥骨下角、骨盤出口部に性差あり
ヒトの骨盤には思春期以降、明確な性差が認められます。しかし、出生前の胎児期における骨盤の性差については、見解が一致していません。ヒトの骨盤は、軟骨原基が骨組織に置き換えられる軟骨内骨化によって形成されます。これまでの胎児期の性差の検討は、軟骨組織から骨組織への置き換え(一次骨化)がある程度進んだ、受精後20週以降が主に対象とされ、一次骨化が開始する受精後9週から対象とした解析はありませんでした。われわれは、京都大学医学研究科附属先天異常標本解析センター及び島根大学医学部解剖学講座が所蔵する、受精後9週から23週に相当する頭殿長 50~225mmのヒト胎児標本72体のMRI画像を取得し、様々な部位の計測と重回帰分析を行なって性差を検討しました。その結果、骨盤上口の前後径、恥骨下角、および坐骨棘間径と大骨盤横径の比に性差が認められました。従来考えられてきた時期よりも早く、一次骨化の開始期には既に骨盤に性差が存在することを示唆する本研究結果は、ヒト胎児骨盤の形態が男女で異なることを理解する上で重要な知見を提供するものです。
1.背景
思春期以降のヒトの骨盤に性差が見られることは広く知られています。では、具体的にいつからその性差が現れるのでしょうか。この点について、多くの研究者が興味を持ち、解析に取り組んできました。しかしながら、これまでの研究成果をみますと、ヒト胎児骨盤の性差の有無については意見が分かれています。さらに、これまでの研究は、主に受精後20週以降の胎児を対象としており、20週以前を対象とした解析は十分ではありませんでした。そのため、私たちは、外性器の肉眼観察から胎児の性別を判定できる最も早い時期であり、一次骨化が開始する受精後9週(頭殿長[注1] 50mm )からのヒト胎児標本を対象として、骨盤の性差を検討することにしました。
2.研究手法・成果
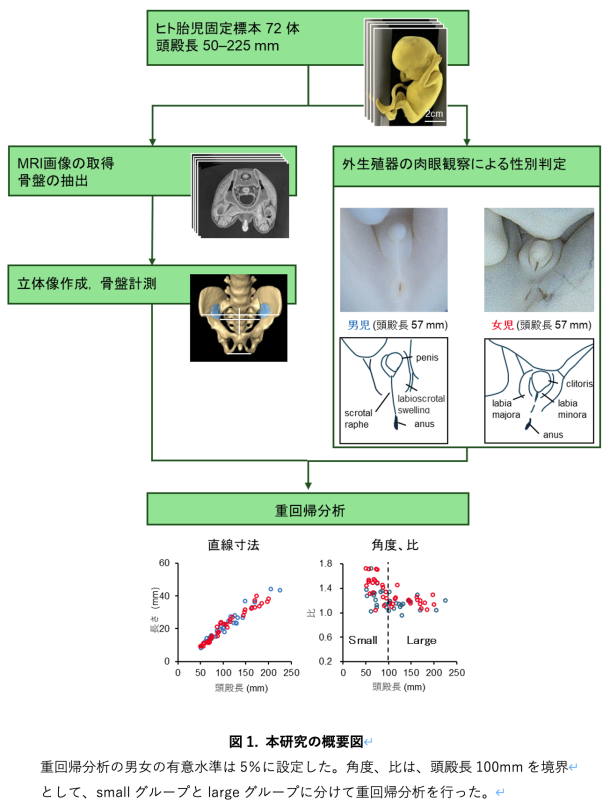
本研究はヒト胎児標本のMRI画像を取得した後、画像解析ソフトを用いて骨盤の立体像を作成しました(図1)。ヒト胎児標本は、京都大学医学研究科附属先天異常標本解析センターと島根大学医学部解剖学講座が保有する標本群を使用しました。この標本群は、世界最大規模の研究リソースとして知られており、その利用については京都大学大学院医学研究科・医学部及び医学部附属病院医の倫理委員会の承認のもとで研究が行われています。
ヒト胎児の性別は外生殖器の肉眼観察から判定しました。肉眼観察を用いた正確な性別判定は、頭殿長50mmの大きさの胎児から十分に可能です。本研究では、頭殿長が50mmから225mmまでのヒト胎児標本72体(男児;34体、女児;38体)のMRI画像を、前臨床用7T及び臨床用7T、3TMRI装置を用いて取得しました。作成した骨盤の立体像から、直線寸法や角度を21か所測定しました。また、直線寸法のデータを用いて計20個の比を算出しました。これらの計測データと重回帰分析を用いて性差を検討しました。
その結果、骨盤上口の前後径、前後径と横径の比、恥骨下角、坐骨棘間距離に対する大骨盤の横径(腸骨稜間距離、上前腸骨棘間距離)の比に有意な性差が確認されました(図2)。本研究成果から、これまでの報告よりも早い一次骨化が開始する受精後9週から、既にヒト胎児の骨盤には性差が存在することが示唆されます。
3.波及効果、今後の予定
本研究成果は、ヒト骨盤の性差に関する理解に大きく貢献し、さらに、骨盤形成の男女の違いについて、発生学や人類学などの様々な領域に新たな視点をもたらすことが期待されます。今回の検討では、なぜ一次骨化開始期から既に性差が存在するのかについては明らかにできていません。今後、ヒト骨盤の形態形成をより深く理解するために、一次骨化開始期以前の骨盤の性差の検討も含めて、より詳細に解析する必要があります。
<研究者のコメント>
本研究では、一次骨化が開始する受精後9週以降の希少なヒト胎児標本と、正確に立体情報を把握できる高解像度MRI画像を取得できたことで、従来では検討できなかった胎児期初期のヒト骨盤を検討し、性差の存在を証明することができました。本成果で得られた新しい知見は、「胎児期のヒトの骨盤では、性差は十分には分からない」と考えられてきた、これまでの定説を覆すという点で大きな価値を持つと考えます。(金橋 徹)
Kanahashi T, Matsubayashi J, Imai H, Yamada S, Otani H, Takakuwa T. Sexual dimorphism of the human fetal pelvis exists at the onset of primary ossification, Communications Biology, 2024, 7:538, https://doi.org/10.1038/s42003-024-06156-y
古典的な発生解剖学に記載されている形態学的特徴は、観察者が得た感覚的なものを含んでいる。その代表的なものとして解剖学的部位の‘移動’がある。‘移動’は、本当に移動する場合(migration)と、偏差成長の結果移動したように見える場合(differential growth)があり、発生期の器官の移動の多くは、differential growthで説明でき、Migrationでないと考えられている。次に示す、初歩的な多元解剖学的解析を用いた外耳、眼球の移動についての解析はdifferential growthについて新たな知見を与えた例である。
外耳の移動
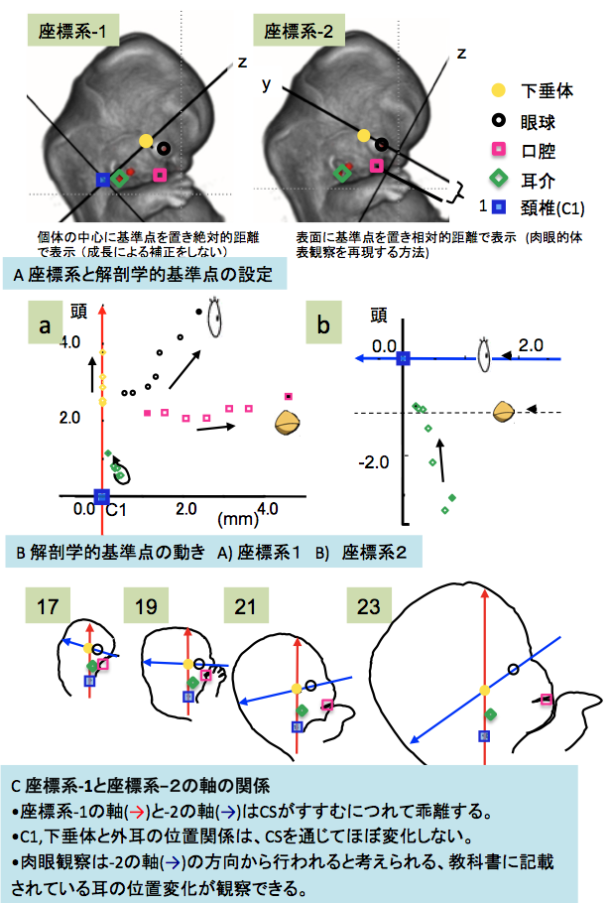
図1 外耳の移動
『胚子期に外耳は顔の側方を頭側に移動して行く』と、多くの発生学の教科書に記載されている。この動きは”移動 (migration)”ではなく ”分化・成長 (differential growth)” で説明できるかどうかを、MRIデータを用いて、個体の中心に基準点をおき、位置変化の絶対値を検討した。
方法; MR顕微鏡を用いて撮像されたCarnegie Stage (CS)17-23に分類される171例の胚子画像を用いた。解剖学的目印(左右外耳(耳珠)、眼、口、下垂体、第1頸椎)を選抜しMR画像上で3次元座標を計測し、2種類の座標系(-1, 2)を用いて位置変化を表示した(図1A)。
座標系-1: 個体の中心に基準点を置き絶対的距離で表示 (位置変化が分化・成長によるか、移動によるかを見分ける方法) 。第1頸椎-下垂体を通る直線を基準 (z軸)とした。これは体軸を決定する脊索の走行にほぼ一致する。顔の大きさの絶対値を維持した(成長による補正をしない)
座標系-2: 表面に基準点を置き相対的距離で表示 (肉眼的体表観察を再現する方法)。眼、下垂体を通る平面を基準(xy平面)(顔を正面から観察するため)、口とxy平面の距離を一定(=1)になるように表し、顔の大きさを相対化した。
結果;外耳は顔を構成する他の解剖学的目印(眼、口)や下垂体と異なり、CSの進行しても頭/尾、背/腹軸方向の原点(頚椎C1)からの位置変化は比較的ゆるやかであった(図1B_a)。図には示していないが、正面からみるとCSの進行に伴い、外耳は他の解剖学的目印と同様、原点から離れていった。外耳の位置変化が眼、口等と異なるのは、両者が異なる顔面原基に由来するためと思われる。座標系−2に従って表示すると、外耳はCSがすすむと、尾側から大きく移動しCS23では口と頭との間に位置した(図1B_b)。
両者の見え方の違いを考察するために、胚子の倍率を変えずに座標系-1、−2の軸の関係を示した(図1C)。座標系-1の軸(→)と-2の軸(→)はCSがすすむにつれて乖離していく、つまり顔面を正面からみるための観察方向は大きく変化することがわかる。これは、顎の発達、頭蓋底の形成の影響によると考えられる。C1,下垂体と外耳の位置関係は、CSを通じてほぼ変化しない。一方、実際の肉眼外表観察では、座標系-2のように、目や口といった顔の表面にある解剖学的基準をもとに相対的な動きとして外耳の位置をとらえるため移動して見えるのであろう。古典的解析ではreference pointを標本の中心に近い内部にとることが困難であった。本研究は、立体情報の長所:外表の点と内部の構造とを連動できる、複数の時期の異なる個体を同一縮尺で重ね合わせられるという長所を持つ、を活かした解析方法といえる。
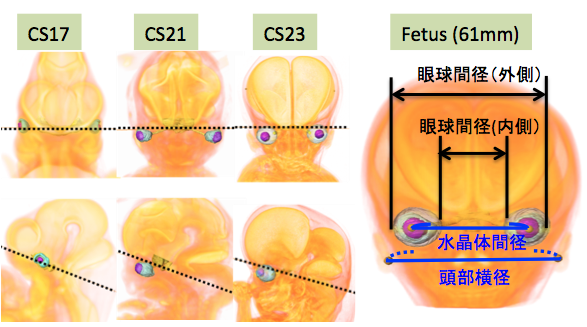
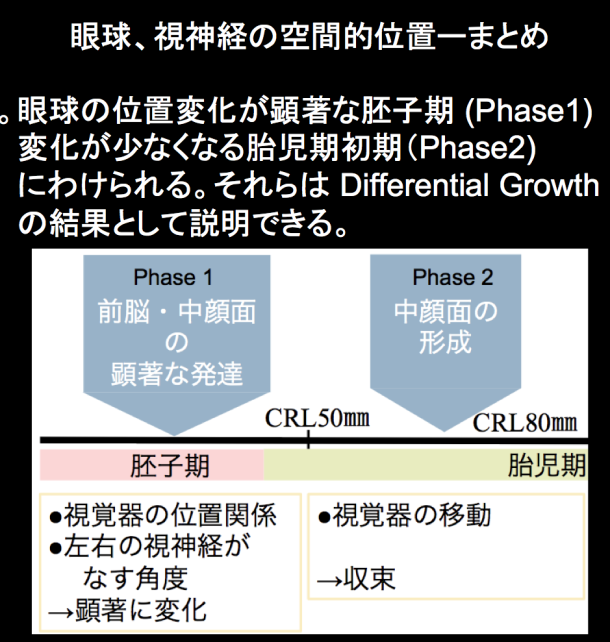
図2 ヒト胎児の眼球の位置の変化(CS17〜胎児期初期)点線は頭蓋底(左右の嗅球と下垂体後葉の下端を含む平面)を表す。
視覚器の位置の移動 本研究では、ヒト胚子期、胎児期初期の個体(CRL12-85㎜)を位相CT、MRIで撮像した画像データを用いて、頭部における水晶体・眼球の立体的位置関係の変化について3次元座標を用いて検討した。
頭部における眼球の位置の変化 (図2)は、 CS17で外側を向いていた眼球は、徐々に腹側へ移動し、胎児期初期では成人とほぼ同じ方向(前方)を向いていた。CS17において頭蓋底面(図2点線)よりも頭側に位置していた眼球は、CS18以降は尾側に位置し、頭蓋底面に対して尾側を向くように移動していた。CS16~CS19での前脳の成長に伴い、視覚器が尾側へ移動し、中顔面(鼻隆起、上顎などの視覚器の周辺器官)の成長により胎児期に位置は決定されることがわかる。
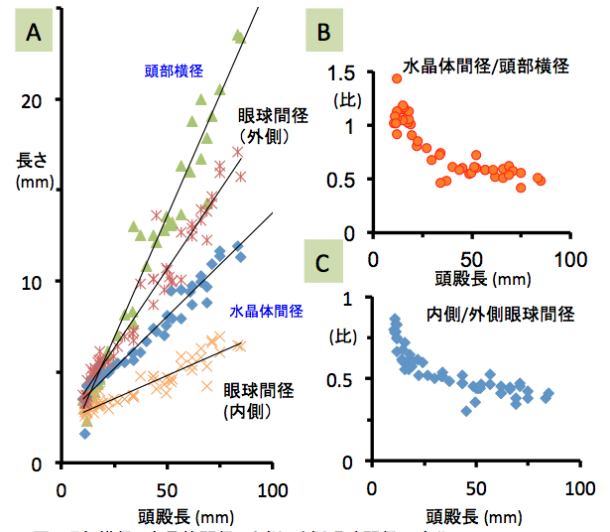
図3頭部横径、水晶体間径、内側・外側眼球間径の変化
頭部横径、水晶体間径、外側・内側眼球間径値は頭殿長の増加に比例して直線的に増大した(図3A)。頭部横径に対する水晶体間距離の比は~CRL30㎜前後の胎児期初期にかけて急激に減少していたが、CRL40㎜以降の胎児期初期では変化があまりみられなくなり、0.4~0.5に収束した(成人は約0.48)(図3B)。内側/外側眼球間径もCRL40mm以降の胎児期ではあまり変化がみられなくなり0.4~0.5に収束した(図3C)。眼球の位置の移動も解剖学的領域が成長するなかで、それぞれの位置関係が変化し位置が決定されていく(differential growth)の結果で説明できると考えられる。
参考文献
Gasser RT. Evidence that some events of mammalian embryogenesis can result from differential growth, making migration unnecessary, Anat Rec B New Anat,289,53–63,2006.
Kagurasho M et al. Movement of the external ear in human embryo, Head Face Med.8, 2, 2012.
Osaka M et al. Positional changes of the ocular organs during craniofacial development, Anat Rec, 2017, in press.
概要
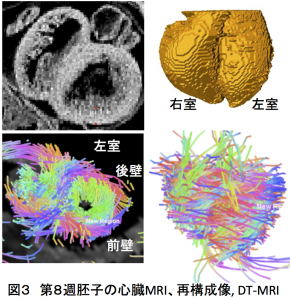
心臓は受精後3週頃には拍動を開始し生涯拍動を続けます。全身に効率よく血液を送るために心筋線維は立体的に規則的に配列される必要があります。近年、拡散テンソルMRIを用いて、心筋線維がどのように配列されているかについても検討できるようになりました。成人では心室の壁を構成する心筋線維は、層状に内側から外側にかけてゆるやかに向きを変えて配列することが示されています。胎児では、胎齢20週ころには成人と同様の心筋線維配列を示すことが知られていますが、拍動開始から20週の間の心筋線維の配列は不明でした。われわれは、京都大学大学院医学研究科附属先天異常標本解析センターが所蔵しているヒト胚標本20体を用いて、ヒト心臓の心筋線維の配列を拡散テンソルMRIを用いて検討しました。その結果、心室の壁が厚みをもち始める胚子期後半の段階において、心筋線維の配列は、成人と同様であること証明しました。今回の結果は、先天性、後天性心疾患の原因解明、診断、治療等に関わる重要な知見と考えられます。
心臓は受精後3週頃には拍動を開始し生涯拍動を続ける、生きるために必須の臓器で、成人では200-300gあります。心臓の大部分は心筋という特殊な筋肉から作られています。特に心室は心筋が袋状になり、全身に効率よく血液を送るために心筋線維が規則的に配列される必要があります。心筋線維の配列は、解剖学者Torrent-Guaspの心筋バンド説(心臓の壁を構成する心筋を広げていくと、1枚の帯状のものになる)が長い間信じられていました。近年、MRIという機器を用いて、心臓を取り出さずに、その形態や構成する物質の性質を調べることが可能になり、心筋線維がどのように配列されているかについても拡散テンソルMRI(DT-MRI)法という解析方法を用いて検討できるようになりました。心室の壁を構成する心筋線維の向きは、どの壁においても、層状に内側から外側にかけてゆるやかに向きを変え、らせん状に配列することが示されており(メッシュモデル)、心筋バンド説は否定されています。
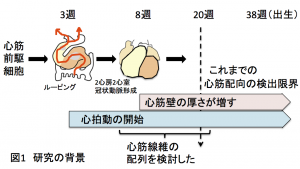
ヒトに心臓の心筋線維の配列は、いつごろからどのように形成されるのでしょうか。これまでの研究では、胎齢20週ころにようやく成人と同様の配列を示すことが報告されています。そうすると、拍動開始(3週)から20週の間も、心臓は拍動しているわけですが、その間、心筋の配列はどうなっているのかという疑問が湧いてきます。そこで我々は、ヒト心臓の心筋線維の配列を24週の胎児から発生をさかのぼって検討することにしました。(図1)
2.研究手法・成果 心筋の壁が組織学的に形成されるには、心臓が2心房2心室の4つの部屋に別れ、冠状動脈という血管が形成され、心筋への血流が確保されるカーネギーステージ(CS)22(第8週中頃)であることがわかっています。そこで、それよりも若いCS20(第8週初め)までを解析対象としました。
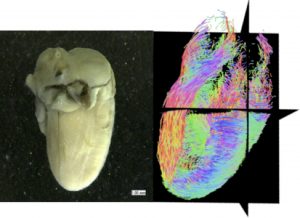
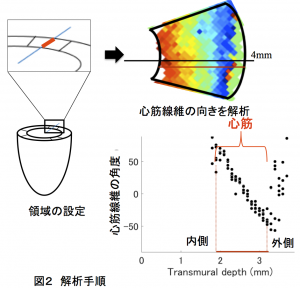
解析の成功のためには、良質なヒト胚子標本の確保と、小さい標本を解析するために解像度の高い撮像装置、撮像条件の検討、解析法の確立が重要です。(胚子期後半の心臓は米粒ほどの大きさしかありません!!)
良質なヒト胚子標本として、附属先天異常標本解析センターが収集、保管している、ヒト胎児大規模標本群(京都コレクション)を使用しました。この標本群は、世界最大規模の研究リソースとして知られており、その利用については京都大学大学院医学研究科・医学部及び医学部附属病院 医の倫理委員会の承認のもとで研究が行われています。撮像装置としては、医学研究科医学研究支援センターが保有している前臨床用7T-MRIを用いました。撮像の対象及び目的に特化させた撮像条件と直径19mmの高感度MRIコイルを併用してDTI撮像データの質の改善を行いました。
その結果、心室の壁が形成され厚みをもち始める胚子期後半の段階(CS20-23)においても、心筋線維の配列は、成人と同様の配列を示すことを示すことができました。(図2、3)
3.波及効果、今後の予定 心臓の病気には、発生過程の異常に基づくものが多くあります。その意味で、今回心臓の動力の源である心筋の配列過程を経時的に追求できたことは大きな意義があります。ただ、心拍動の開始から8週までの期間については、装置の解像度の問題から現在の方法での解析が難しく今後の課題と言えます。今回の結果は、先天性、後天性心疾患の原因解明、診断、治療等に関わる重要な知見で、その発展に貢献することが期待されます。また、今回得られたDT-MRI撮像、解析技術は、心臓以外の他の臓器の形態形成の解析にも応用できるものと考えられます。
<研究者のコメント> 胚子期後半の心筋線維の配列がすでに大人の配列と同様というのは、当然とは言い切れません。発生学の原則として、“ヒト胚子はその発生の各段階で生きており、各段階で適切な状態を維持している”(Heuser & Streeter 1941)があります。それに従えば、心臓(心筋)は、成人の完成図を目指して性急な成長をするのではなく、発生段階の心臓の形状や他の諸器官と協調して、心筋の走行や分布、成長が異なることも十分に想定されることだからです。
<西谷さんの修士論文の概要>
Nishitani S, Torii N, Imai H, Haraguchi R, Yamada S, Takakuwa T, Development of helical myofiber tracts in the human fetal heart: Analysis of myocardial fiber formation in the left ventricle from the late human embryonic period using diffusion tensor magnetic resonance imaging. Journal of the American Heart Association, 2020, 19(9) doi:10.1161/JAHA.120.016422
Willis輪とは
Willis輪は、脳底部において、椎骨動脈と内頚動脈の枝が連絡して形成される輪状ないし六角形の動脈吻合物で、脳への血液供給を担う。それは、1本の前交通動脈(Acom)と、左右の前大脳動脈(ACA)、内頸動脈(ICA)、後交通動脈(Pcom)、後大脳動脈(PCA)の5種類の動脈から構成される。Willis輪は、脳血流を安定させ、一定に保つ側副血行路としての作用があり、脳血管の閉塞や狭窄において血流の代償的メカニズムとして役立つとされている。また、血流よりも血圧の安定化に重要という説もある1-3 。その形態は多様であり、完全な輪状を成す個体は、ヒト成人では約5-28%といわれている。また、ヒト成人では、特にAcom(5~32 %)やPcom(23~81 %)、前大脳動脈のA1領域(1~16 %)、後大脳動脈のP1領域(7~29 %)に低形成・無形成が生じやすいとされているが、報告によりばらつきがみられる4 。それらは脳梗塞などの脳血流障害の重症度や予後を左右する1.2 。
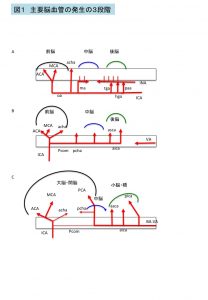
図1 主要脳血管の発生の3段階
Willis輪ができるまで
Pagetは脳内の血管系の形成について7段階にわけ詳細かつ精確に記述しており、現在まで多くの教科書、論文で引用されている5.6 。
脳血流は、Carnegie stage(CS)13 (受精後約30日)ころまでは、背側大動脈から分岐する内頚動脈(ICA)と,脳幹部に沿って網状に伸びるlongitudinal neural artery (INA)からなる。INAは脳幹の左右に分布する血管で、網状に分岐、融合を繰り返している。内頚動脈はCS11~13(受精後約25-30日)に発達がみられる。内頚動脈とINA間には、血管吻合(segmental artery)が複数みられる(図1A; 三叉神経動脈(tga), 舌下神経動脈(hga),前環椎動(paa))。
CS14(受精後約33日)に後交通動脈が形成され、左右のINAが次第に融合し脳底動脈(BA)を形成し始めると、これらsegmental arteryは消退する。このようにsegmental arteryは、発生途中の4-8日間限定でみられ、比較的太い三叉神経動脈もCS17(受精後約43日)ころには消退する。これらsegmental arteryの遺残は、成人でもみられることがあり、脳外科領域の手術時に問題になることがある。
CS16(受精後約40日)ころに椎骨脳底動脈(VA+BA)は完成する。CS17には前大脳動脈・中大脳動脈(MCA)・後大脳動脈(PCA)の大脳動脈の発達が顕在化する。胚子期では、加えて前後の脈絡叢動脈(acha, pcha)の発達が目立つのが特徴である。これは、脈絡叢が胎児期中盤から大脳の栄養供給など機能的に重要な役割を果たすことと関係がある(図1B)。成人のWillis輪のvariationのうち胎児型(fetal type)と呼ばれるもの(後大脳動脈のP1領域の途絶)は、図1Bの時期のものを想定して命名されている7 。大脳半球後部、中脳、後脳,の血流供給は、内頚動脈由来の後交通動脈を介しての血流が胚子期初期から中期の一定期間こそ役割の多くを担うが、次第に椎骨脳底動脈系(VA.BA)の血流が優位となる。この傾向は、発生が進み大脳の発達が著明になるにつれて、内頚動脈由来の多くの血流が前大脳動脈, 中大脳動脈領域の大脳に割り当てられることと関係がある(図1C)7 。後大脳動脈の発達とともに後交通動脈、前後の脈絡叢動脈,は退縮する。
CS20~21(受精後約52-54日)に前交通動脈を介して左右の前大脳動脈が吻合することでWillis輪が完成するとPagetは述べている5.6 。本邦の標本を用いた我々の検討ではWillis輪の完成はCS22-23頃(受精後55-60日)と、Pagetの報告よりも若干遅かった8 。人種による差かもしれないが、理由は不明である。
胚子期末(CS23,受精後60日ころ)の特徴
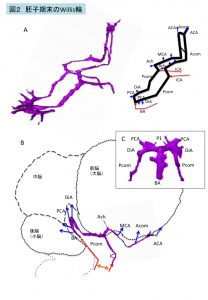
図2 胚子期末のWillis輪
胚子期末の完成直後のWillis輪は成人と比較すると以下のような特徴がある(図2)8 。
1) Willis輪は平面上になく、階段状である。また、後部の脳底動脈-後交通動脈との接続領域にはヘアピン状の大きな屈曲がみられる。これは、胚子期の脳胞の中脳上方の強い頭屈(cephalic flexure)や間脳の腹側の形状に沿うためである(図2B)。
2) 強い屈曲部は太く、多くの血管が出る。胚子期末では、大脳の前半部に比べて、中脳、後脳、大脳半球後部の血管は再構成の途上であると考えられる5.6 (図2C)。
3)内頚動脈は蛇行している。また、後交通動脈の分岐点と中大脳動脈とは、成人と比較して離れている。
4)後交通動脈は成人と比較して長い。
5) 椎骨脳底動脈は2本の網状に走るINAが癒合し形成されるため、太さが一様でなくしばしば蛇行する。窓形成(Fenestration)や脳底動脈の重複等もみられることがある。
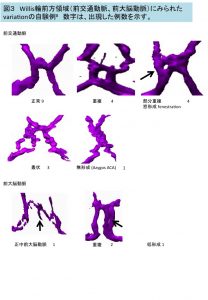
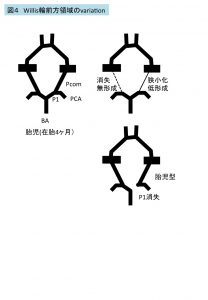
図3 Willis輪前方領域(前交通動脈、前大脳動脈)にみられたvariationの自験例8 数字は、出現した例数を示す。
胚子期末のWillis輪の個体差(variation)
Willis輪の個体差は基本的には成人のそれと同様の部位にみられる。
自験例20例のうちVariationは17例にみられ内訳は—前方部のみ10例(前交通動脈、前大脳動脈), 後方部のみ1例(後交通動脈)、前方と後方の合併6例である。後方部のvariationは、すべて一方の後交通動脈の径が細い例(hypogenesis)であった。
前交通動脈、前大脳動脈のvariationの例、頻度は図3の通りで、成人4 、胎児、新生児、幼児9-13 でみられるvariationの内訳、頻度と概ね同じであった。前交通動脈の重複は胎児期には優位であると報告される14 .叢状の前交通動脈は胚子期のWillis輪完成前には多くみられることから成人のそれは残存であると考えられる6 。正中前大脳動脈(Median ACA)は、脳梁等への血液供給を担い、通常は血管再構成によりのちに消失する脳梁中間動脈である。胎児・新生児では64%にみられるが成人でも(3.2~22.0%)に残存する14,15 。前大脳動脈の低形成のため、代償的に正中前大脳動脈が発達する可能性が考えられている。前交通動脈領域にみられた窓形成(fenestration), 叢状、正中前大脳動脈は、同領域における脳動脈瘤に関与する可能性がある。
後方部を構成する血管(脳底動脈,後大脳動脈、P1領域)やそこから分岐する血管は太く、後交通動脈はそれと同等かやや細いとされている16 。自験例では、後方部のvariationは、いずれも一方の後交通動脈の径が細い例であった。
図4 Willis輪前方領域のvariation
胎児期から出生まで
Willis輪の血管径は胎児期前半までは、部位による差は顕著ではないが、4ヶ月頃から差が出てくるとされ、後交通動脈はP1に比べ細くなる17,18 。この現象は、上述したように中脳、後脳や後大脳動脈などの後部大脳半球の血流供給が、次第に椎骨脳底動脈系の血流に優位に依存することと関係する。
一方で、P1の血流のない胎児型のvariationは4ヶ月以降にみられ始め、出生時には20%程度にみられると言われる9,12,13,19 。
まとめ
胚子期の脳血管の走行は、脳の成長に伴う需要に応じて、分岐、融合を繰り返す叢状の血流から再構成し確立した血管に変わっていく。このことがvariation,異常例、動脈瘤を生む遡上となっている。Willis輪についていえば、前方部の領域(前後交通動脈、前大脳動脈)は胚子期にすでに多様性がみられ、それが成人期に及んでいる可能性は十分に考えられる。一方、後方部におけるP1の途絶は、胚子期には見当たらず胎児期中期ころからの変化と考えられる。後交通動脈は、胚子標本の一部で低形成がみられる。一方で加齢とともに後交通動脈の狭小化、閉塞をきたすデータも報告されており6 、先天的なもの(hypogenesis),後天的なもの(萎縮等の退行性変化)の両者を考える必要があると考えられる。
参考文献
Furuichi K, Ishikawa A, Uwabe C, et al. Variations of the circle of Willis at the end of the human embryonic period. Anatomical Rec 2018, 301, 1312-9.
■ はじまり
カーネギーコレクションは Franklin P Mall(1862-1917)が、Wilhelm His (1831-1904)とともにドイツのライプチヒでヒト胚子の収集を開始したことが始まりです。1887年からMallが集めた813体を基盤として、それにいくつかの胚子コレクション(Hertig AT, Rock Jなど)を追加したものがカーネギーコレクションです。カーネギー研究所には、1900年初頭から40年代半ばまでの間に約9,000体の標本が集められました。
現在はNational Museum of Health and Medicine of the Armed Forces Institute of Pathology内のHuman Developmental Anatomy Centerに保管されています。
His W (1831-1904)
Streeter GL, (1873-1948)
Mall FP, (1862-1917)
• カーネギーステージ
収集したヒト胚子を分類するためには、胚子の成長の基準を作成すること必要でした。1914年、Mall は形態学的特徴を指標にした最初のStagingを提唱しました。これは、カーネギーコレクションに所属した2-25mmの266体のヒト胚子をHからUまでの14のstageに分けたものです。その際、日齢、大きさは胚子の成長の基準にすることは困難でした。ヒトにおいては発生開始日を正確に決めることが困難であることや、固定による収縮などが影響することが理由であると考えられます。彼らは、さらに胚子の連続切片の作成、stageごとに3次元モデルの作成も行っており、その数は100を超えました。研究者、科学者だけでなく、芸術家、写真家、工芸家までも含めたチームを結成してヒト発生学を開拓していったのです。後継者であるStreeter(1873-1948)は1920年頃からアカゲザルを用いて胚子の解析を行いヒトに当てはめるという手法でヒト胚子の発生の理解を深めました。そして30mmまでのカーネギーコレクションの胚子を1-23の発生段階にわけたStaging(当時はHorizonと命名)を発表(1942)しました。1987年にこのStagingにO’Rahillyらが改良を加えました.これがカーネギーステージの完成版で、現在、ヒト胚子の記載、分類の上での国際的な標準となっています。
O’Rahillyらのステージングの教科書のpdfはこちらから
Heard OO (1891-1983)
O’Rahilly R (1921-2018)
Didusch JD (1890-1955)
はじめに
カーネギー研究所に保存されているEmbryo No.836は、受精後28-32日のStage13という妊娠の最も初期の段階の胚子です。わずか4mm程度の小さい、しかし現在に伝わる最も有名な胚子のひとつです。誕生してほぼ100年間、No.836はヒト胚子学の中心的存在でした。No.836は研究材料として切り刻まれ、そこからイラスト、写真、モデルが作成され、多くの雑誌に登場し、写真集、21世紀に入ると3D,4D化された映画にも登場しています。こんな生命の象徴としてスター街道を歩みつづけたNo836の物語です。
胚子標本の生い立ち
この胚子の生い立ちは、多くを知られている訳ではありません。バージニア西部の田舎に生まれ育った、結婚4年目妊娠歴ない25歳女性がいました。1914年の新年初頭、腹部のしこり、出血を主訴にBaltimoreにある John Hopkins clinicsを受診した彼女は、担当医Dr. Ruselに子宮筋腫の診断で子宮全摘を告げられます。そして2月の月曜の朝、Marylandの婦人科病院で彼女の子宮は取り出されました。それは猛吹雪がちょうどBaltimoreの街を通り抜けて行くまさにそのときであったといいます。その後の彼女についての記録はありません。手術で助かったかどうか。不妊になったその後、彼女がどのような人生を送ったのか、さらに取り出した子宮から小さな美しい娘(1)が宿っていたことを彼女が知ったかどうかも、もはや知ることはできません。
彼女の子宮は摘出後その場であけられ妊娠が確認されるとただちにカーネギー研究所に運ばれて処理されました。病院と研究所でそういう取り決めを以前からしていたからです。1950年代まで妊娠女性の子宮を摘出することは繰り返し行われていました。当時妊娠テストはなく、外科医は決して妊娠を終わらせる意図はなく、摘出した子宮から偶然妊娠が分かるという具合でした。そして、発生学者はその偶然に依存していました。つまり、外科手術は胚子を集める貴重な手段でもあり、また、新鮮で完全な標本は病院から得られた標本であるというのは、間違うことのない事実でした。カーネギー研究所に保管されるStage13の胚子のうち状態のよい”excellent”に分類される個体は26例中9例にすぎず、そのうち7例は妊娠女性の外科手術によるもので、その内訳は子宮摘出5例,子宮切除1例、卵管妊娠1例であったといいます。予期せぬ外科手術による中絶という悲劇から、ヒトの胚子標本は誕生していた訳ですが、当時の状況について付け加えると、摘出され死に絶えたヒト胚子のその後の利用については、当時、倫理的な問題を取り沙汰されることはありませんでした。1900年代初頭、胚子学者以外にとって、それは価値のないものだったのです。こうして多くの名もない胚子が、社会の陰で研究材料として蓄積されて行ったのです。このようにしてカーネギー研究所には、1900年初頭から40年代半ばまでの間に約9,000体の標本が集められたと言います。これがカーネギーコレクションです 。
胚子のモデル化
この胚子をカーネギー研究所最初に受け取り解析を行ったのはDr. Herbert McLean Evans(2)でした。Evansはこんなすてきな子をありがとうと、担当医Dr. Ruselに手紙を送ったと言います。研究室に運び込まれたNo.836は、変性しないように固定され写真撮影をされました。研究者の興味は、ヒト胚子の精確な外表、内部構造の記載にありました。そのため、No836は、全身は15ミクロの厚さに正確に切られ247枚の標本に分解されました。続いて、標本のスケッチ、立体像の再構成、イラストの作製に使用されました。立体モデルの作製は技術者Osborne O Heard が担当し、No.836から少なくとも心臓4、血管系1、脳1、外形1の7体が作成されました。彼のモデル作成能力は抜群で、完成したモデルからは多くの図表、イラストが作成されました。イラスト画家としてはDidusch JFが有名で何10もの学術書にNo.836のイラストは採用されました。このようにNo.836は、その美しさ、完璧さから人気を集め、”Kate Moss” of Embryologyとも言われているそうです。
No.836がこのように貴重な標本であったことから、こんなエピソードも残されています。No.836を精力的に解析していたEvansは、1915年カルフォニア大学に教授として栄転するこのになるのですが、研究所長のMall はNo.836を持ち出すことを許可しませんでした。EvansはいずれMallの後継者になるであろうと言われていたほど、その才能を認められており、また、2名は親密でいたのですが、No.836をめぐる三角関係で溝ができ、以後それが埋まることはありませんでした。
新しい可視化スタイル
Heardの模型はお世辞にも美しくはありませんが、美しい必要もありませんでした。胚子学者の興味は上述したように外観、内部構造の正確性が最優先であったからです。一方、60年台になると胚子の可視化には学術的要素だけでなく、教育や娯楽の要素が加わってきました。Lennart Nilssonが1965年雑誌Lifeに掲載した胎児写真は斬新で人々の注目を集めました。バックライトで照らし、暖みのある色、赤ちゃんらしい顔、手足、親指をしゃぶるようなしぐさ等です。また、最近ではTsiaras Aの出版した”Conception to Birth”では、コンピューターグラフィックス等を駆使し、色彩鮮やかで、劇的な可視化を実現しています。
このように時代が代わり表現形が変わっても元をたどるとカーネギー研究所で集められたNo.836を含む胚子標本を用いていることが分かります。Tsiaras Aはこの出版物で「カーネギーコレクションに敬意を表し捧げる」旨表紙裏に書いています。しかしながら、この本のどこを見ても、これらの画像が死んだ胚子標本から創られたものとは思わないでしょう。この本では、胚子は生命の象徴なのですから。こうした書籍は、胚子標本を用いて科学的に正しいものを提供してはいますが、その明るすぎるメッセージ性のために、科学的な負の面、たとえば多くの受精卵は子宮に定着できない、自然流産の多さなどを隠してしまっています。
胚子を動かす
90年代になると胚子標本はコンピューターに取り込まれ高解像度のデジタル画像となります。さらに、その胚子画像に動きが与えられ、生命を吹き込まれました。動画の作成は、グラフィックスの進歩により技術的に可能になったこと、理解しやすい学生用教材の必要性、胚子を扱った娯楽的企画に対する需要、さらにこの分野に多額の研究費が投入されたことが原因で進歩を遂げました。No.836が3次元の世界を飛び回る胚子動画プロジェクトに NIHの予算 300万ドルが投じられました。 virtual embryo , visible embryo- といったプロジェクトでもNo.836はモデルの主役をつとめています。No.836は現在世界で最もよく知られているヒト胚子と言って過言ではありません。No.836はon lineで様々な方向、速さで動く姿を見ることができ、247全断面の組織像も見られます。
No.836に限ったことではなく、すべての集められたヒト胚子には、それぞれ語り継がれるべき物語があります。かつては女性の体内に生を受けたものが、道をそれて、身の毛のよだつような終焉を迎え、小さな肉の切れ端に終わるかと思いきや、研究室へ連れていかれ、科学的に有用な標本となり、それは芸術家の心を捉えるようになりました。3D ,4D動画の材料となり、今や、研究者や美術館の資金源にもなっています。
No.836は、単なる死んだ研究標本から、”セレブ”な姿を利用した資金源へ変貌しました。100年の間に胚子をとりまく環境は変わったのです。No.836は、カメラの前で宙返りをしたり、電脳空間を旅したり、テレビ出演のリハーサルをしたりと、死んだ胚子でも長く実りある生活を送れることを示しています。No836はまさに生命の象徴、そう美しく感動的で、不思議に満ちた、すばらしい生の誕生の象徴。我々は、しかし、そういったまばゆいばかりの光の中に覆い隠された、死んだ胚子たちの陰のメッセージにも気づかなくてはならないと思います。
参考文献
Morgan LM: A Social Biography of Carnegie embryo No.836, the anatomical record, 2004 の内容を一部改変し記載
注釈
1:この胚子は、Dr. Gasser Rにより核内にBarr bodyがあることがわかり女であると確定されている
2:Herbert McLean Evans1882–1971はカルフォニア大学で成長ホルモンの単離Vitamin Eの発見、生成、構造式の決定など数々の業績を残した。
19世紀末から20世紀初頭、ヒトの発生が記述されるようになると、複雑な変化を理解するため、また得His の観察データをもとに作成されており、モデルの説明には、”nach His”と書かれています。1893年シカゴで行われた博覧会に出展されたモデル群は、まさに人類の誕生、進化を可視的に体現したものとして賞賛を受けました。
当時2次元の情報を3次元にかつ拡大する技術は容易ではありませんでした。Ziegler はそれをFree handで職人技として行いました。それは隅々までの解剖学的な理解と芸術的な精巧さが必要でした。彼はノギスで測定しヘラやスプーンを用いてひとつひとつ微調整を繰り返し、作品を作り上げて行ったのです。小さな平面上の情報を立体可視化したそのインパクトは相当なものだったと思われます。Zieglerはその息子とともに工房を南ドイツFreiburgに設立しました。その小さな兄弟会社は、半世紀の間の活動中に、多数の有名な模型を世に送りました。
モデルの作製法は技術革新がありました。ミクロトームを用いた連続組織切片を元に1断面づつの平板を作成して積み上げて行く方法(stacked plate method)が、Born G(1851-2000)らによって行われるようになると、作製法は平易で、早く安く客観的になり、モデル作成の間では標準的な方法になりました。しかし、Zieglerのfree hand法を信奉する発生学者も多くみられました。科学の進歩とともに発生学の分野も、事実の記述中心の研究から実験を主体とするものに変貌しました。それに伴いZieglerのモデルの需要は減少し、やがてひっそりとその歴史をとじました。しかし、輩出された多くのモデルは、ヒト発生学の体現としてヨーロッパやアメリカの大学で使われ続けました。それは、ヒトとは何か、どうやってつくられるのかーといった人間誰もが一度は抱く崇高な問いに対する解のひとつと言えなくもありません。
Blechschmidt E (1904-1992) ドイツのGöttingen大学内にあります。同大学は1737年に創設され270年近い歴史があり13学部を有する総合大学です。45名のノーベル賞受賞者を輩出することでも知られます。
Blechschmidt Collectionは医学部解剖学教室が現在保管しています。高品質の組織切片と64体の精巧な大型模型が特長で、これらは受精後8週間のほぼすべての期間の胚子をカバーしています。64体の胚子はガラスのケースに入れられ全方位から観察可能で、一般公開もされています。これらは外表に加えていくつかの器官系(循環器、呼吸器、消化器、中枢神経、骨格系など)を精確に復元しています。大きさは75cm程の大きさがあります。
2012年9月、私たちは同コレクションを訪れました。建物の地下一階にガラスケースに入れられた胚子模型が整然と並べられ、不思議な雰囲気のする空間でした。
2015年からGöttingen大学との共同研究 で貴重な胚子組織標本やのデジタル化に取り組んでいます。
(ゲッティンゲン大学ヒト胚子コレクションの組織学的解析およびデジタルアトラス作成;基盤(B)(海外)
Ueno S, Yamada S, Uwabe C, Männer J, Shiraki N, Takakuwa T, The digestive tract and derived primordia differentiate by following a precise timeline in human embryos between Carnegie stages 11 and 13, Anatomical Rec 2016, 299, 439-449, DOI: 10.1002/ar.23314s,
Miyazaki R, Makishima H, Männer J, Sydow HG, Uwabe C, Takakuwa T, Viebahn C, Yamada S. The Blechschmidt Collection: revisiting specimens from a historical collection of serially sectioned human embryos and fetuses using modern imaging techniques, Congenit Anom, 2018, 58, 152-157, doi: 10.1111/cga.12261















 胚子のモデル化
胚子のモデル化



 2012.9.24撮影
2012.9.24撮影