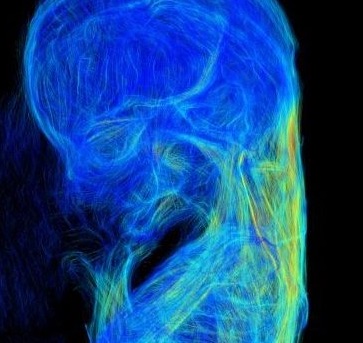
病院等でみられる医療用に普及しているCTは、X線が物質を透過する際の透過率(吸収率)の変化をコントラストとして三次元の画像にするものです(吸収コントラストX線CT法)。これに対して、位相コントラストX線CT法は、X線が物質を透過する際に生じる位相変化をコントラストとして三次元の画像にする方法です。X線の吸収率が小さい軽元素(水素、炭素、酸素など)で構成されている生体試料では、従来の吸収コントラストX線CT法に比べて分解能を1000倍も高くすることができます。共同研究者である山田重人博士は、高エネルギー加速器研究機構 (KEK;筑波)の研究施設(Photon Factory)を共同利用してヒト胚子の高解像度データを取得する研究を進めています。得られた貴重な撮像データを私たちは解析に用いています。
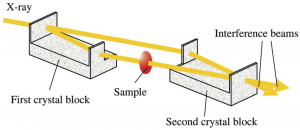
図1 位相CTの原理
位相CTの原理
三次元イメージング法のうち、マイクロX線CTは、ヒト胚のような柔らかい標本では通常のX線CTでは透過してしまい撮像ができません。またMR顕微鏡では詳細な解析に至る解像度が得られていません。そこでわたしたちは、位相X線顕微鏡(位相CT)を用いることにいたしました。 位相CTは波としてのX線は物質を透過すると位相がシフトすることを利用し、この位相差を画像化することで、従来の吸収X線によるイメージングの1000倍の感度を実現したもので、解像度はMR顕微鏡の10倍近くになる可能性があります(図1)。日立・高エネ研・北里大の共同研究グループが開発した撮像システムは、(BL-14C)に常設されています[3-5]。
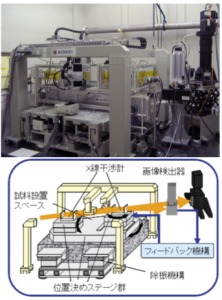
図2位相CT装置(BL-14Cに常設)
BL-14Cに常設された位相CT装置は、非対称結晶を用いた拡大ミラー、分離型X線干渉計位置決め機構、画像検出器、試料位置決め機構、フィードバック機構から主に構成されています。BL-14の垂直ウィグラーから放射されたX線はSi(220)結晶で単色化され、さらに非対称結晶により横方向に拡大されて、X線干渉計に入射します。干渉計で形成された干渉ビームのうち一方は画像検出器で検出し、他方はフィードバック用として利用します。試料は基礎から独立した位置決め機構により、干渉計の光路に設置します。
3次元測定は、試料をX線に対して回転して行います。標本はアガロースゲルに包埋し、そのゲル塊を回転台に固定する方法をとります(図3)。標本はBL-14Cに常設された位相コントラスト型イメージングシステムの標準的な試料ステージを用いて設置します。標本の大きさは最大3cm程度であり、上記ステージで十分な位置決めを行うことができます。標本は水で満たしたセル内に設置します。これは標本の蒸発を抑制すると同時に、空気と標本の大きな密度差を低減するためです。CTを実施するために、標本を固定した棒をセル外からモータにより回転させます。

図3 サンプルセルにゲル包埋した標本を水没させたもの。矢印:サンプルセル、矢頭:回転軸。この軸の回転により、CT像を得る。
位相CT撮像の実際
現在、割り当てられたビームタイムに合わせてヒト胚子標本を施設に持ち込んで撮像をしています。1体あたりの撮像に3−6時間かけ、1日4−6体、ほぼ24時間、装置を稼働しております。たまに訪れるビームダンプと地震は難敵で、再撮像を余儀なくされることがあります。あとは、過酷なつくばの気候(特定のメンバーが連れてくるという噂もあります)。
プロジェクトの現状と成果
ヒト胚子の位相CT撮像法としては一定の手法を確立した状態で、撮像標本数も200程度になりました。それらを用いて、全身様々な部位の器官、組織等の発生に伴う変化を解析しています[1]。位相CTを用いることで、貴重な標本を破壊せずに解析できます。また、撮像された画像は立体構築が正確であることから、三次元的な形態観察、計測に適しています。くわえて、二次元の断面像を任意に取れる、レンダリングにより臓器の位置の把握が容易である、多くの個体をコンピューター上で比較検討しやすいなど、デジタルデータならではの多くの長所があります。これらの長所を生かしたヒト胚子研究はほとんどなく、得られる知見は大変有意義です。
今後の課題
グループの米山らは、「X線干渉法を用いたZeffイメージング法」(標本内の実効原子番号の空間分布を画像化する方法)の開発を進めています [6]。新規の観察手法ですが、これまでと標本準備や機器のセッティングは同じで、位相イメージングに加えて吸収像の撮影を追加するだけで元素に関する情報を画像化可能であるという点が大きな利点です。この手法で生物標本を網羅的に観察した例は皆無です。Zeff法を用いることで、器官発生に伴う質的な変化、代謝による物質の合成、貯留を定量、組織構造の形成に伴う物質分布の変化についての情報を付加することが可能です。発生に伴う代謝や機能的な変化、組織構造学的な変化について新たな知見を得、発展に貢献すると思われます。また、その異常についても捉えられる可能性があることから先天性代謝疾患、中毒性疾患についても新たな知見が得られる可能性があります。また、より安定した実験装置周辺環境で、より高い空間分解能、濃度分解能の画像を得るためのビームライン、X線干渉計の高度化に関する検討や加速器の先生方とともに挿入光源の高度化に関する検討も行なっています。